kovy
 |
Kovy tvoří společně s polokovy a nekovy tři hlavní skupiny chemických prvků. Rozdělení je prováděno s ohledem na vazebné a ionizační vlastnosti prvků. Kovy jsou charakterizované jako elektropozitivní, mají snahu předávat valenční elektrony a tvořit jednoatomové kationty. Kovy jsou hojně průmyslově využívány pro svoje ojedinělé fyzikální vlastnosti a pro snadnou zpracovatelnost. První zpracování kovů bylo uskutečněno asi 7 tisíc let před naším letopočtem na území dnešního Turecka. V průmyslu se označení kovy také obecně používá pro kovové materiály - slitiny kovů nebo kovů s nekovy. V astronomii jsou za kovy označovány všechny prvky mimo vodík a helium. Zastoupení kovů charakterizuje metalicita.
|
Skupiny kovů v periodické tabulce
|
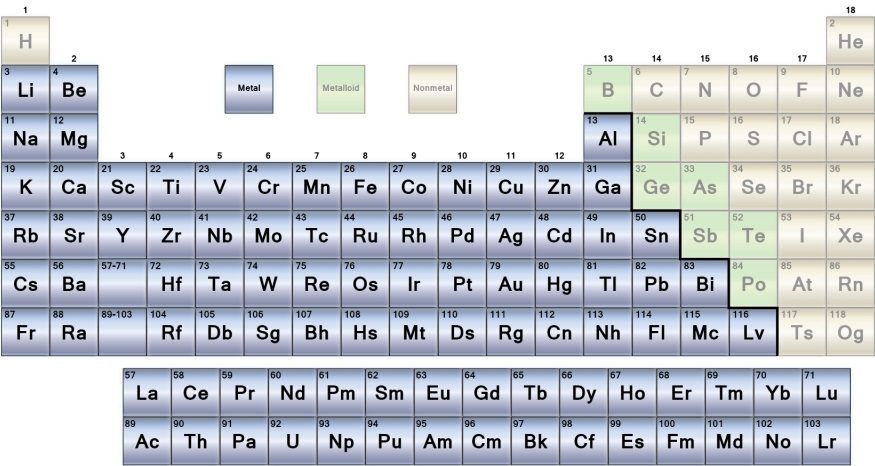 |
 |
Většina kovů se v přírodě vyskytuje v podobě oxidů, některé - zejména těžší kovy, jako rtuť a olovo - se vyskytují jako sulfidy. Jenom některé - zejména vzácné kovy a tzv. mincovní kovy - se vyskytují v ryzím kovovém stavu, neboť patří mezi chemicky nejstabilnější. Právě pro nízkou chemickou reaktivitu se používají v mincovnictví a klenotnictví, neboť nekorodují. Určité kovy se v přírodě nevyskytují vůbec, protože jsou radioaktivní a zmizely díky radioaktivnímu rozpadu.
Technecium a všechny prvky s atomovým číslem vyšším než plutonium vznikají v jaderných reaktorech nebo urychlovačích, zatímco promethium se vyskytuje jen ve stopových množstvích jako produkt spontánního štěpení uranu. Nejtěžší prvky byly získány pouze v množství několika atomů a jsou velmi silně radioaktivní. Vlastnosti
Toxické kovy jsou kovy (antropogenního nebo přirozeného původu, avšak ve vyšší koncentraci než je optimální) mající toxické účinky. Mezi toxické kovy jsou řazeny např.: kadmium, rtuť, olovo. Významnou skupinou toxických kovů jsou těžké kovy. Mezi kovy patří všechny chemické prvky kromě: H, He, B, C, N, O, F, Ne, Si, P, S, Cl, Ar, Ge, As, Se, Br, Kr, Sb, Te, I, Xe, At a Rn. stejnorodé směsi obsahující více než 1 kov se nazývají slitiny. Typickými slitinami, známými z běžného života, jsou např. amalgámy, alpaka, bronz, dělovina, zvonovina, dural, mosaz, ocel, bílé zlato, liteřina, ložiskový kov... |
